Een nieuwe hoop in de behandeling van glioblastoom
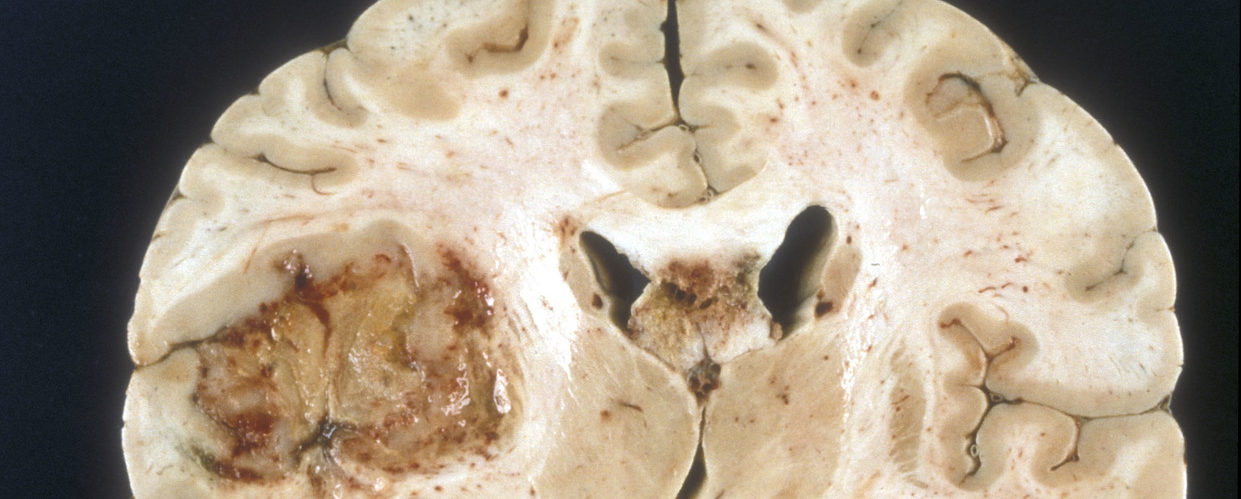
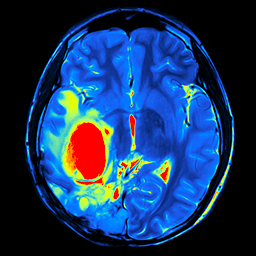
Het glioblastoom, een diagnose die de haren van vele dokters doet rechtkomen. En niet zonder reden. Een glioblastoom is een extreem agressieve hersenkanker met helaas daaraan ook een slechte prognose gekoppeld. De gemiddelde overleving bevindt zich namelijk rond de 15% [1]; hoewel een beperkte groep van patiënten (ongeveer een 2 à 5%) langer dan 3 jaar kan blijven leven [2]. De klachten die een glioblastoom geeft verschijnen meestal over een periode van weken tot maanden en bestrijken een spectrum van hoofdpijn, misselijkheid en braken naar epileptische aanvallen, en van verlammingsverschijnselen en gevoelsuitval tot taal-, spraak- en zichtproblemen. U begrijpt het wellicht wel; er moet én wordt hard gezocht naar nieuwe manieren om deze hersenkanker te bestrijden.
Wat kunnen we vandaag?
De huidige behandeling bestaat, indien mogelijk, uit het weghalen van zoveel mogelijk tumor. Helaas is dit echter nooit voldoende; er zijn immers altijd wel kleine tumorcelletjes verspreid over de hersenen die niet zichtbaar zijn voor de chirurg. Ook de nabehandeling is bij iedereen wel wat anders (voornamelijk afhankelijk van iemands algemene conditie en leeftijd) en kan radio-en/of chemotherapie omvatten [3, 4].
Glioblastomas, een hele familie
Hoewel we wel spreken over ‘het glioblastoom’ is dit niet een eenzijdig gegeven. Een glioblastoom ziet er immers niet altijd identiek uit. Vergelijk het met een auto: hoewel verschillende personen hetzelfde merk kunnen gekocht hebben, heeft de ene zijn auto een ander kleurtje of een sterkere motor dan de andere. Wel, zo gaat het bij glioblastomas ook. Enkele jaren terug werden er vier grote groepen ontdekt die mesenchymaal, proneuraal, neuraal en de klassieke gedoopt werden [5]. Maar zoals het altijd gaat in de geneeskunde is niet alles mooi zwart-wit. Elke type kan nog eens cellen typerend voor een ander subtype bevatten en daarnaast ook ‘stamcellen’, cellen die nog alle kanten kunnen op gaan en zich dus omvormen tot cellen typerend voor elk van de vier subtypes [6, 7]. Deze diversiteit oftewel heterogeniteit, eigen aan het glioblastoom zorgt dat de tumor zo moeilijk te behandelen is. Er zijn altijd wel cellen die ontsnappen aan de therapie en zo zorgen voor de verdere groei van de tumor. Hoewel dit de zaken alleen maar lijkt te bemoeilijken, schuilt hier mogelijks ook een nuttig therapeutisch doelwit in!
En wat kunnen we morgen?
Een recent onderzoek zou een mechanisme hebben gevonden om een glioblastoom van subtype te doen wisselen en zo een minder agressieve vorm te bekomen [8]. Elk glioblastoom produceert namelijk bepaalde moleculen die men microRNA noemt. Dit microRNA heeft de eigenschap dat het kan zorgen dat bepaalde genen onderdrukt of net gestimuleerd worden. Met andere woorden: het regelt de celfunctie. Zo speelt het een rol in de regulatie van de afbraak, delen, … van cellen. Een verandering in de hoeveelheid van dit microRNA kan het hele moleculaire landschap van de tumor veranderen. En ja, aangezien elk tumorsubtype grosso modo een andere hoeveelheid van een bepaald type microRNA heeft (miR-128), kan een verandering (via ingewikkelde technieken) van de hoeveelheid microRNA zorgen dat de tumor overgaat in een ander (iets minder kwaadaardig) subtype. Zo zou men door het verhogen van de concentratie bij een mesenchymale vorm (wat de kwaadaardigste vorm is) een klassiek subtype kunnen krijgen. Door het verlagen van de concentratie bij de proneurale vorm kan men tevens het iets minder kwaadaardige klassiek subtype krijgen, gekenmerkt door een minder heterogene populatie cellen.
De mogelijkheid om de meer agressieve glioblastomas in mildere vormen te transformeren opent de deur naar het gebruik van miR-128 als een nieuwe therapie in de behandeling van glioblastomas. Dit is dus weer een stapje vooruit in de strijd tegen deze uiterst agressieve hersentumor.
Bronnen
- Stupp, R. (2005). Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma. New England Journal of Medicine, 352(10), 987–996.
- Krex, D., Klink, B., Hartmann, C., Von Deimling, A., Pietsch, T., Simon, M., … Schackert, G. (2007). Long-term survival with glioblastoma multiforme. Brain, 130(Pt 10), 2596–2606.
- Khosla, D. (2016). Concurrent therapy to enhance radiotherapeutic outcomes in glioblastoma. Annals of translational medicine, 4(3).
- Showalter, T. N., Andrel, J., Andrews, D. W., Curran, W. J., Daskalakis, C., & Werner-Wasik, M. (2007). Multifocal glioblastoma multiforme: prognostic factors and patterns of progression. International journal of radiation oncology, biology, physics, 69(3).
- Phillips, H. S., Kharbanda, S., Chen, R., Forrest, W. F., Soriano, R. H., Wu, T. D., … Aldape, K. (2006). Molecular subclasses of high-grade glioma predict prognosis, delineate a pattern of disease progression, and resemble stages in neurogenesis. Cancer cell, 9(3).
- Mao, P., Joshi, K., Li, J., Kim, S.-H., Li, P., Santana-Santos, L., … Nakano, I. (2013). Mesenchymal glioma stem cells are maintained by activated glycolytic metabolism involving aldehyde dehydrogenase 1A3. Proceedings of the National Academy of Sciences, 110(21).
- Patel, A. P., Tirosh, I., Trombetta, J. J., Shalek, A. K., Gillespie, S. M., Wakimoto, H., … Bernstein, B. E. (2014). Single-cell RNA-seq highlights intratumoral heterogeneity in primary glioblastoma.(CANCER GENOMICS)(Report)(Author abstract). Science, 344(6190).
- Rooj, A. K., Ricklefs, F., Mineo, M., Nakano, I., Chiocca, E. A., Bronisz, A., … Bronisz, A. (2017). MicroRNA-Mediated Dynamic Bidirectional Shift between the Subclasses of Glioblastoma Stem-like Report MicroRNA-Mediated Dynamic Bidirectional Shift between the Subclasses of Glioblastoma. CellReports, 19(10), 2026–2032. doi:10.1016/j.celrep.2017.05.040