Pijn, we kennen het (helaas?) allemaal. Maar hoe werkt het nu precies? In het merendeel van de gevallen wijst pijn op (een dreigende) schade ergens in ons lichaam, alhoewel er soms ook geen oorzaak kan worden gevonden. Het hele traject van schade tot pijngevoel begint bij wat men de ‘nociceptoren’ noemt. Nociceptoren zijn zenuwuiteinden die verspreid over het lichaam voorkomen en gespecialiseerd zijn in het ‘voelen’ van pijn. Bij een pijnlijke prikkel zenden ze een elektrisch signaal via zenuwbanen richting ons ruggenmerg en van daaruit gaat dit signaal verder naar onze hersenen (figuur 1) [2, 3]. Vervolgens ‘lezen’ onze hersenen dit signaal en reageren hierop onder de vorm van een pijngevoel [2]. Hoewel u waarschijnlijk wel kan beamen dat dit niet het meest prettige gevoel is, zou een leven zonder pijn een absolute nachtmerrie zijn. Over de jaren heen zijn er zo’n 40-tal gevallen beschreven van mensen die geen pijn voelen [4]. Hoewel dit misschien op het eerste zicht zeer fijn lijkt, missen deze mensen bijgevolg ook de belangrijke waarschuwende functie die acute pijn heeft. Zo merken ze het niet als ze ergens tegen slaan, in hun vingers snijden, of zelfs als ze te lang in dezelfde houding zitten (wat voor drukwonden zorgt). Deze mensen sterven dan ook vaak op jonge leeftijd aan hun verwondingen. Er zit dus meer achter acute pijn dan louter een onaangenaam gevoel.
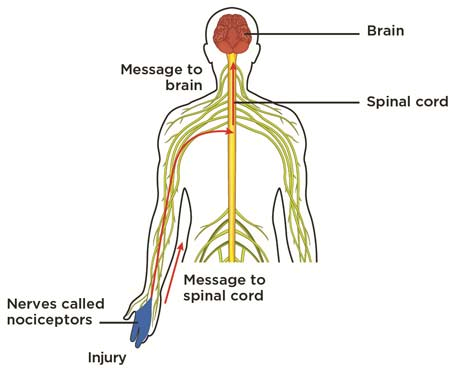
Figuur 1: Pijn verplaatst zich vanuit de periferie, via het ruggenmerg (spinal cord), naar de hersenen (Bron: http://www.nps.org.au)
Chronische pijn, de duistere kant van pijn
Een heel ander verhaal is dat van chronische pijn; pijn die langer dan drie maanden blijft bestaan. Chronische pijn is wereldwijd een belangrijk probleem. Onderzoek toont aan dat 15 tot 25% van de volwassenen hiermee af te rekenen krijgt. Dit cijfer loopt zelfs op tot 50% bij de 65-plussers [5]. De behandeling bestaat momenteel enerzijds uit het behandelen van de onderliggende oorzaak en anderzijds uit pijnverlichting [6]. Voor dit laatste worden momenteel paracetamol (misschien u wel bekend onder de merknaam Dafalgan) en NSAID’s gebruikt (waartoe het bekende aspirientje behoort). Bij ergere gevallen kan men overgaan tot opioïden. Zoals de lange bijsluiters ons vaak vertellen, veroorzaakt een medicament naast een aantal gewenste effecten helaas ook een aantal neveneffecten. Bij opioïden zien we bijvoorbeeld, vooral initieel, een gevoel van misselijkheid. Ook ‘verstopping van de darmen’ (constipatie) is een veelvoorkomend probleem. Om nog maar te zwijgen over de afhankelijkheid die men kan ontwikkelen. Naast deze nevenwerkingen werken de opioïden meer systemisch, en dus niet specifiek gericht op de welbepaalde regio in het lichaam waar de pijn vandaan komt. U hoort het al aankomen; hoog tijd voor iets nieuws!
Licht als eenvoudige oplossing voor een complex probleem
En deze nieuwe behandelingsmethode kwam er in de vorm van licht. Licht als behandeling voor chronische pijn, klinkt fantastisch, niet? Hoewel uw dokter deze behandeling helaas nog niet aanbiedt, hebben onderzoekers van de Canadese McGill University reeds belangrijke vooruitgang geboekt op dit domein [1].
De wetenschappers richtten zich hierbij op het blokkeren van Nav1.8+-zenuwcellen. Dit type zenuwcellen zou een belangrijke rol spelen bij het geleiden van pijnprikkels richting de hersenen, waardoor het blokkeren van deze cellen zou resulteren in minder pijn. Het probleem is dat ze echter niet te blokkeren zijn met geneesmiddelen. Dit komt omdat ze heel erg lijken op andere zenuwstructuren die in ons lichaam voorkomen. Bijgevolg zou ook de functie van deze structuren in het gedrang komen bij het toedienen van medicatie. De wetenschappers kozen er dan ook voor om in te zetten op een recentere techniek: optogenetica. In dit experiment maakt men gebruik van opsine, een eiwit dat ook terug te vinden is in het oog en gevoelig is aan licht. Dit opsine wordt uit bacteriën gehaald en is specifiek gevoelig aan geel licht. Hier gingen ze muizen genetisch zo aanpassen dat op de Nav1.8+-zenuwcellen dit opsine werd gevormd. Door vervolgens met geel licht op de huid te schijnen, gaan de opsines van vorm veranderen. Hierdoor zullen ze, via een ingewikkelde cascade van reacties, de geleidbaarheid van de Nav1.8+-zenuwcellen, waarmee ze verbonden zijn, verminderen. Hierdoor wordt de pijnprikkel afgezwakt en zal deze zwakkere prikkel, eenmaal aangekomen in de hersenen, als minder pijnlijk worden ervaren.
Dit zag men nadat men bij muizen in de achterpoot deze opsines had aangebracht via genetische technieken. Men vergeleek vervolgens hoe snel de muis zijn pootje terugtrok na het geven van een pijnlijke prikkel ter hoogte van de achterpoot in aan- en afwezigheid van lichttherapie. Hierbij onderscheidt men twee gevallen: ofwel gaf men een korte lichttherapie van slechts een fractie van een seconde door met geel licht op het pootje van de muis te schijnen, waarbij men een sterke vermindering van de pijnervaring zag. De gevoeligheid van het pootje voor een niet-pijnlijke prikkel bleef tevens bewaard. In het tweede geval scheen men met geel licht gedurende een volledig uur op het pootje. Hierbij zag men dat de muizen niet alleen minder pijn voelden, maar dat dit effect tot zelfs een dag lang aanhield!
Hoe realistisch is dit nu bij de mens?
Aangezien we bij de mens uiteraard niet zomaar met genen kunnen beginnen knoeien, is het inbrengen van de opsines (voorlopig) nog een obstakel. Een mogelijke manier om dit te overwinnen is door gebruik te maken van virussen [7]. Hoewel een virus inbrengen om iemand te genezen misschien wat paradoxaal lijkt, gaat het hier om een virus waaraan zodanig ‘gesleuteld’ is dat het zijn ziekmakende activiteit verloren heeft. Deze virussen zouden dan de opsines in de zenuwcellen kunnen inbrengen. Analoge technieken bleken in het verleden reeds succesvol in de behandeling van Parkinson en de ziekte van Alzheimer [8].
Het grote voordeel van deze techniek in vergelijking met de opioïden is vooral dat deze nieuwe behandeling ons in staat zou stellen veel gerichter de pijn aan te pakken door eenvoudigweg het pijnlijke lichaamsdeel te beschijnen, waardoor ook de nevenwerkingen van de opioïden (verkregen door de ongewilde systemische effecten) kunnen worden voorkomen. Bovendien kan men ook preciezer dan bij opioïden de tijdsduur van het effect gaan bepalen.
Optogenetica staat vandaag de dag nog maar in kinderschoenen, maar is op weg om een grote rol te gaan spelen in de geneeskunde. Het lijkt dus nog maar een kwestie van tijd totdat we eenvoudigweg naar onze pijn moeten schijnen om ze te laten verdwijnen.
Referenties
- Inflammatory, A., Pain, N., Daou, I., Beaudry, H., Ase, A. R., Wieskopf, J. S., … Séguéla, P. (2016). Optogenetic Silencing of Na v 1 . 8-Positive Afferents, 3(February), 1–12.
- David, B., & Lorimer, M. (2013). Explain Pain 2nd Edition. Noigroup Publications.
- Siddall, P., McCabe, R., Murray, R., & Lucy, J. (2013). The Pain Book: Finding Hope when it Hurts. HammondPress.
- Inani, K., & Mernissi, F. (2014). Images in medicine: Insensibilité congénitale à la douleur, 8688, 8688. doi:10.11604/pamj.2014.18.197.4753
- Brennan, F., & Carr, D. B. (2007). Pain Management : A Fundamental Human Right, 105(1), 205–221. doi:10.1213/01.ane.0000268145.52345.55
- Graziottin, A., Gardner-nix, J., Uk, M., Stumpf, M., & Berliner, M. N. (2011). Opioids : How to Improve Compliance and Adherence, 11(6), 574–581.
- Albert, P. R. (2014). Light up your life : Optogenetics for depression ?, 39(1), 3–5. doi:10.1503/jpn.130267
- Weinberg, M. S., Samulski, R. J., & Mccown, T. J. (2013). Neuropharmacology Adeno-associated virus ( AAV ) gene therapy for neurological disease. Neuropharmacology, 69, 82–88. doi:10.1016/j.neuropharm.2012.03.004